
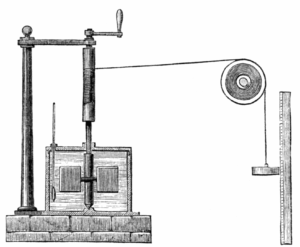
La termodinámica moderna nace con Sadi Carnot (el joven de la foto). Ingeniero y militar francés vinculado a la revolución francesa (su padre había formado parte del gobierno de la revolución, y él sirvió como militar para Napoleón), se interesó por las máquinas de vapor y escribió un libro, Réflexions sur la puissance motrice du feu (1824), con un análisis teórico* de los límites de su eficiencia. En este libro, Carnot ideó el ciclo reversible que lleva su nombre (expansión isoterma en contacto con un reservorio caliente, expansión adiabática, compresión isoterma en contacto con un reservorio frío, compresión adiabática), y argumentó que no era posible un ciclo más eficiente, porque si lo hubiera se podría combinar con éste para transferir “calórico” de una fuente fría a una caliente (lo cual consideraba imposible porque el calórico siempre “caía” de los cuerpos calientes a los fríos). Es decir, Carnot dio en el clavo! Básicamente, entendió cuáles son las limitaciones universales para una máquina térmica, sólo que lo hizo con una descripción incorrecta de lo que es el calor. Según Carnot y sus contemporáneos, el calor era una sustancia (este “calórico”) que se transfería de los cuerpos calientes a los fríos. Esta idea fue rebatida por el inglés James Joule en la década de 1840, con una serie de experimentos en los que demostraba que el calor no era una sustancia sino una forma de transferir energía. En el experimento más famoso, Joule introdujo unas paletas en un recipiente lleno de agua, unidas a un peso mediante una soga (ver la imagen de abajo). Dejando caer el peso, las paletas giran y calientan el agua. El descubrimiento de Joule es lo que hoy conocemos como la primera ley de la termodinámica.
El libro de Carnot de 1824 pasó desapercibido, y Carnot murió en 1832, a la edad de 36 años, sin saber del gran impacto que iban a tener sus ideas. Dos años después de su muerte, en 1834, otro ingeniero francés, Émile Clapeyron, publicó un comentario sobre las Réflexions que dio visibilidad al libro. El alemán Rudolf Clausius y el británico William Thomson (más conocido como Lord Kelvin) leyeron el comentario de Clapeyron y se interesaron por la obra de Carnot. Fueron ellos dos, por separado, quienes, alrededor de 1850, adaptaron las ideas de Carnot a la descripción de Joule de lo que es el calor, dando origen a la segunda ley de la termodinámica. El nombre “termodinámica” fue acuñado por Kelvin en 1849; la entropía fue introducida por Clausius en 1865.
En la década de 1870, el norteamericano Josiah Willard Gibbs extendió el dominio de aplicación de la termodinámica, aplicándola al estudio de las reacciones químicas. En ese proceso introdujo conceptos como el potencial químico, la entalpía y la energía libre de Gibbs, y dio una descripción algo más formal de la termodinámica, un poco más parecida a la que vimos en clase.
*Fe de erratas: en clase dije que creía que la contribución original de Carnot había sido experimental; no es cierto, fue teórica. También dije que Carnot había sido enviado a Inglaterra por el rey de Francia en la época de la restauración borbónica; si bien esto se dice en algunas referencias, no es un hecho contrastado.

Deja un comentario